El día lunes 6 de Julio se dará inicio a los ensayos para la graduación a partir de las 8 de la mañana.
Solución Concentrada
viernes, 3 de julio de 2015
domingo, 10 de mayo de 2015
BIOLOGIA: ¿Cómo se clasifican los seres vivos?
En nuestro planeta existen millones de seres vivos distintos, que tienen caracteristicas que los identifican para asi formar grupos. Los seres vivos pueden ser desde una pequeña célula como las amebas (que sí, no dejan de ser seres vivos) hasta nosotros, los seres humanos que estamos compuestos de miles de millones de células que tienen trabajos distintos.
Distintas maneras de clasificar, serían las especies que son grupaciones que tienen características parecidas y se pueden reproducir entre sí. Un ejemplo serían los perros, no todos son exactamente iguales (refiriéndome a las distintas razas y cruzas) pero pueden reproducirse entre si por ser de la misma especie.
Otra forma más general, sería por reinos, que vendrían siendo el tipo de organismo. Por ejemplo un hámster sería del reino animal, y un hongo del reino fungi. Ambos seres vivos pero sus características los localizan en cierto reino.
Los reinos en los que se clasifican los seres vivos son:
REINO ANIMAL: Como su nombre lo señala, esta formado por todos los animales. Y sus caracteristicas principales son que sus células forman tejidos. Se alimentan de otros seres vivos para vivir. Tienen sistema nervioso y organos que les permiten percibir su entorno, por lo que reaccionan a estimulos con más facilidad. En este reino hay una pequeña subdivisión (al menos una de muchas más...) que son los vertebrados e invertebrados. Los vertebrados tienen un esqueleto y una columna vertebral, que usan para desplazarse junto con el sistema locomotor. Mientras que los invertebrados, carecen de esto. En invertebrados se podrían mencionar caracoles, gusanos, medusas, estrellas de mar, etc.
REINO VEGETAL (PLANTAE): Todas las plantas. Son los unicos seres capaces de producir alimento par asi mismos, y a esto se le llama ser autotrofos. Sin embargo no tienen sentidos y no pueden desplazarse. Las plantas pueden o no tener flores. Cuando las poseen son su medio de reproducción, aunque pueden tambien reproducirse por medio de frutos.
Distintas maneras de clasificar, serían las especies que son grupaciones que tienen características parecidas y se pueden reproducir entre sí. Un ejemplo serían los perros, no todos son exactamente iguales (refiriéndome a las distintas razas y cruzas) pero pueden reproducirse entre si por ser de la misma especie.
Otra forma más general, sería por reinos, que vendrían siendo el tipo de organismo. Por ejemplo un hámster sería del reino animal, y un hongo del reino fungi. Ambos seres vivos pero sus características los localizan en cierto reino.
Los reinos en los que se clasifican los seres vivos son:
- Animal
- Vegetal
- Fungi
- Proctoctista
- Mónera
 |
| Los caracoles son invertebrados, sin embargo, su caparazón no cuenta como esqueleto. |
miércoles, 29 de abril de 2015
sábado, 25 de abril de 2015
Métodos de separación de la materia
Son métodos físicos que se utilizan para poder separar los componentes de una mezcla y conseguir así las sustancias que lo componen en su estado más puro, generalmente para su posterior análisis.
Hay diferentes métodos para separar una mezcla dependiendo de estado y propiedades de la misma. Muchos básicamente se basan en los cambios del estado de la materia: Líquido-gas, sólido-gas, líquido-sólido, etc.
►Decantación
Se utiliza para separar solidos de un líquido en una mezcla heterogénea. En estos casos el soluto no se termina de disolver o no lo hace por lo que las partículas son grandes y visibles. Un ejemplo de esto podría ser cuando se separan los asientos del café de olla. También puede ser útil para separar líquidos que no se mezclan y uno flota encima del otro, ya que este método se basa en la diferencia de densidades.
►Destilación
Es para separar mezclas homogéneas líquidas. Para llevarse a cabo de pone a calentar un mezcla hasta que uno de los componentes alcanze su punto de ebullición y se evapore, este vapor se recupera posteriormente y se pasa a estado líquido por fuera de la mezcla. Este método esta basado en la diferencia de puntos de ebullición de los componentes de la mezcla.
►Evaporación
Se utiliza el cambio de estado de líquido a gaseoso de uno de los componentes. De manera similar a la destilación, se pone a calentar la mezcla hasta que una de las sustancias se evapora, a diferencia de el otro método, en este no se recupera el gas de la otra sustancia. Mediante esto se puede obtener una disolución más concentrada que la original o para recuperar el sólido de una disolución.
►Cristalización
Mediante la cristalización se pueden separar los sólidos disueltos en algún líquido. Su fundamento es la diferencia de solubilidad de ambos componentes a distintas temperaturas. Consiste en enfriar la solución, uno de ellos se precipita en el momento en el que la temperatura no favorece la solubilidad. Muchas sales son purificadas por este método.
►Sublimación
En esta técnica se separa de modo que uno de los componentes se sublima, osea, pasa de estado sólido a gas sin pasar por el estado líquido. Se calienta suavemente el recipiente que contiene la mezcla y se reciben los vapores de la sustancia que se sublima, para después cristalizarlos poniendolos en contacto con una superficie fría.
►Magnetismo
Útil para separar un material metálico con propiedades magnéticas de otro que no las tiene. También se puede imantar un material para separarlo por medio del magnetismo. Se pasa un imán por la superficie de la mezcla y se retira de este la sustancia metálica.
Hay diferentes métodos para separar una mezcla dependiendo de estado y propiedades de la misma. Muchos básicamente se basan en los cambios del estado de la materia: Líquido-gas, sólido-gas, líquido-sólido, etc.
 | ||
| Los cambios de estado suelen ser fundamentales en la separación de mezclas. |
►Decantación
Se utiliza para separar solidos de un líquido en una mezcla heterogénea. En estos casos el soluto no se termina de disolver o no lo hace por lo que las partículas son grandes y visibles. Un ejemplo de esto podría ser cuando se separan los asientos del café de olla. También puede ser útil para separar líquidos que no se mezclan y uno flota encima del otro, ya que este método se basa en la diferencia de densidades.
 |
| Si se pone en un vaso con arena y agua y se espera a que la arena se asiente en el fondo, al vertir el agua en otro recipiente la arena quedará en el fondo dejando pasar el agua. |
►Destilación
Es para separar mezclas homogéneas líquidas. Para llevarse a cabo de pone a calentar un mezcla hasta que uno de los componentes alcanze su punto de ebullición y se evapore, este vapor se recupera posteriormente y se pasa a estado líquido por fuera de la mezcla. Este método esta basado en la diferencia de puntos de ebullición de los componentes de la mezcla.
 |
| Destilación |
Se utiliza el cambio de estado de líquido a gaseoso de uno de los componentes. De manera similar a la destilación, se pone a calentar la mezcla hasta que una de las sustancias se evapora, a diferencia de el otro método, en este no se recupera el gas de la otra sustancia. Mediante esto se puede obtener una disolución más concentrada que la original o para recuperar el sólido de una disolución.
►Cristalización
Mediante la cristalización se pueden separar los sólidos disueltos en algún líquido. Su fundamento es la diferencia de solubilidad de ambos componentes a distintas temperaturas. Consiste en enfriar la solución, uno de ellos se precipita en el momento en el que la temperatura no favorece la solubilidad. Muchas sales son purificadas por este método.
 |
| El fenómeno de la cristalización es el que permite que se formen estalactitas en la cuevas. |
En esta técnica se separa de modo que uno de los componentes se sublima, osea, pasa de estado sólido a gas sin pasar por el estado líquido. Se calienta suavemente el recipiente que contiene la mezcla y se reciben los vapores de la sustancia que se sublima, para después cristalizarlos poniendolos en contacto con una superficie fría.
 |
| El hielo seco y el Yodo son materiales que se subliman. |
Útil para separar un material metálico con propiedades magnéticas de otro que no las tiene. También se puede imantar un material para separarlo por medio del magnetismo. Se pasa un imán por la superficie de la mezcla y se retira de este la sustancia metálica.
Etiquetas:
decantación,
destilación,
Estados de la materia,
Mezclas,
separación
jueves, 5 de marzo de 2015
Experimento: Estados de la materia, cambios de estado en el agua.
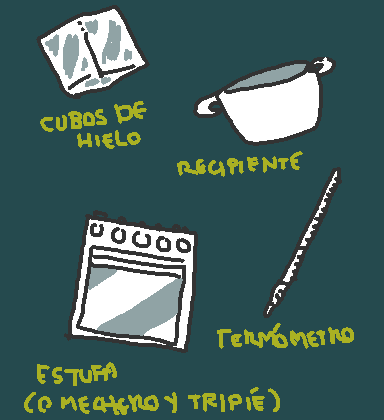
Materiales:
♦Cubos de hielo (10 aproximadamente son suficientes)
♦Un recipiente (olla) que se pueda calentar.
♦Estufa o mechero de gas o alcohol (ademas del tripié si planeas usar esta opción)
♦Termómetro de laboratorio
Procedimiento
■Coloca los cubos de hielo en el recipiente, toma la temperatura y regístrala. Esta será la temperatura inical.
●Calienta el recipiente hasta tener agua en ebullición. Ve registrando la temperatura cada 2 minutos y anota los estados de agregación que van observando.
■Sigue calentando hasta que el volumen del agua quede a la mitad.
Para observar
♦En un cuadro, registra las temperaturas y estados que fuiste observando, después contesta las siguientes preguntas.
※¿De qué están hechos los hielos? ¿En qué estado físico se encuentran?
※¿Qué es lo que sucede cuando se calientan?
※El líquido que se obtiene al calentar los hielos, ¿está hecho de la misma sustancia que estos?
※¿Que le sucede al líquido cuando se sigue calentando?
※¿Que se observa cuando el agua alcanza el punto de ebullición?
※¿En qué estado se encuentra ahora el agua?
♦Cubos de hielo (10 aproximadamente son suficientes)
♦Un recipiente (olla) que se pueda calentar.
♦Estufa o mechero de gas o alcohol (ademas del tripié si planeas usar esta opción)
♦Termómetro de laboratorio
Procedimiento
■Coloca los cubos de hielo en el recipiente, toma la temperatura y regístrala. Esta será la temperatura inical.
●Calienta el recipiente hasta tener agua en ebullición. Ve registrando la temperatura cada 2 minutos y anota los estados de agregación que van observando.
■Sigue calentando hasta que el volumen del agua quede a la mitad.
Para observar
♦En un cuadro, registra las temperaturas y estados que fuiste observando, después contesta las siguientes preguntas.
※¿De qué están hechos los hielos? ¿En qué estado físico se encuentran?
※¿Qué es lo que sucede cuando se calientan?
※El líquido que se obtiene al calentar los hielos, ¿está hecho de la misma sustancia que estos?
※¿Que le sucede al líquido cuando se sigue calentando?
※¿Que se observa cuando el agua alcanza el punto de ebullición?
※¿En qué estado se encuentra ahora el agua?
miércoles, 4 de marzo de 2015
Estados de la materia
Como se apreció en las propiedades intensivas la materia tiene puntos en los que se realiza un cambio de estado. Estos puntos pueden variar dependiendo de la sustancia, siendo los puntos de congelación, fusión y ebullición propiedades intensivas. Retomando el ejemplo del agua, cuando la temperatura está debajo de los 0 grados, el estado de esta es sólido. Pasando los 0 hasta los 99 grados, se mantendrá en un estado líquido y al sobrepasar los 100 se continuará con el estado gaseoso por el hecho de haber sobrepasado el punto de ebullición. No todas las sustancias presentan los tres estados de agregación en sus condiciones ambientales, como pasa con el agua.
Otra cosa que cabe destacar es que la temperatura de fusión del agua es 0°C y la de ebullición 100°C al nivel del mar, donde la presión es 790 torr. Sin embargo, en la ciudad de México, que se encuentra a 2,200 metros sobre el nivel del mar, el punto de ebullición es de 93°C (por eso mencionaba que la presión y temperatura influían en los cambios de estado), ya que la presión atmosférica en esta zona es de 585 torr, osease, menor. Así que la presión que tienen que vencer las partículas es menos y se alcanza más rápido el punto de ebullición
Y sobre el hecho de que alguna adición de otra sustancia pueda modificar los puntos de congelación, fusión y ebullición, es debido a que la sustancia ya no se encuentra pura. Por ejemplo, la sal puede hacer que la temperatura de congelación del agua descienda hasta -10 grados, lo que explica por qué en las carreteras en las que ha caido nieve, para que la nieve se derrita incluso si la temperatura está por debajo de los 0°C, ya que el punto de congelación del agua con sal son -10°C.
Aunque entrando bien al tema, los estados de la materia son 3: sólido, líquido y gaseoso.
►Sólido
♦Los solidos tienen forma y volumen constantes.
♦Las partículas pueden moverse vibrando u oscilando alrededor de posiciones fijas, sin embargo, no pueden moverse libremente a lo largo del sólido, que en los líquidos y los gases, es lo que hace que puedan "adaptarse" a distintos espacios vacíos de materia.
♦Al aumentar la temperatura se aumenta la vibración de las partículas.
►Líquido
♦Tienen un volúmen constante.
♦La fuerza de atrancción entre las partículas es menor, lo que permite que estas se puedan mover un poco más libremente que los sólidos y que estas se adapten a distintas formas, sin perder su volúmen.
♦El número de partículas por unidad de volúmen es alto, por lo que las fricciones y colisiones entre ellas son constantes.
♦En los líquidos, el movimiento es desordenado
♦Al aumentar la temperatura, se aumenta el movimiento de las partículas.
►Gaseoso
♦Los gases no tienen ni forma ni volumen fijos.
♦Son fluidos, como los líquidos
♦Las fuerzas que mantienen a las partículas de los gases unidas, es muy pequeño.
♦Las partículas se mueven de manera desordenada, con choques entre ellas y las paredes del recipiente que las contiene.
♦Si las partículas se comprimen demasiado, el gas pasara a un estado líquido.
♦Al aumentar la temperatura, las partículas se mueven con más energía y chocan con más fuerza contra las paredes de su recipiente, lo que genera presión.
Otra cosa que cabe destacar es que la temperatura de fusión del agua es 0°C y la de ebullición 100°C al nivel del mar, donde la presión es 790 torr. Sin embargo, en la ciudad de México, que se encuentra a 2,200 metros sobre el nivel del mar, el punto de ebullición es de 93°C (por eso mencionaba que la presión y temperatura influían en los cambios de estado), ya que la presión atmosférica en esta zona es de 585 torr, osease, menor. Así que la presión que tienen que vencer las partículas es menos y se alcanza más rápido el punto de ebullición
Y sobre el hecho de que alguna adición de otra sustancia pueda modificar los puntos de congelación, fusión y ebullición, es debido a que la sustancia ya no se encuentra pura. Por ejemplo, la sal puede hacer que la temperatura de congelación del agua descienda hasta -10 grados, lo que explica por qué en las carreteras en las que ha caido nieve, para que la nieve se derrita incluso si la temperatura está por debajo de los 0°C, ya que el punto de congelación del agua con sal son -10°C.
Aunque entrando bien al tema, los estados de la materia son 3: sólido, líquido y gaseoso.
►Sólido
♦Los solidos tienen forma y volumen constantes.
♦Las partículas pueden moverse vibrando u oscilando alrededor de posiciones fijas, sin embargo, no pueden moverse libremente a lo largo del sólido, que en los líquidos y los gases, es lo que hace que puedan "adaptarse" a distintos espacios vacíos de materia.
♦Al aumentar la temperatura se aumenta la vibración de las partículas.
►Líquido
♦Tienen un volúmen constante.
♦La fuerza de atrancción entre las partículas es menor, lo que permite que estas se puedan mover un poco más libremente que los sólidos y que estas se adapten a distintas formas, sin perder su volúmen.
♦El número de partículas por unidad de volúmen es alto, por lo que las fricciones y colisiones entre ellas son constantes.
♦En los líquidos, el movimiento es desordenado
♦Al aumentar la temperatura, se aumenta el movimiento de las partículas.
►Gaseoso
♦Los gases no tienen ni forma ni volumen fijos.
♦Son fluidos, como los líquidos
♦Las fuerzas que mantienen a las partículas de los gases unidas, es muy pequeño.
♦Las partículas se mueven de manera desordenada, con choques entre ellas y las paredes del recipiente que las contiene.
♦Si las partículas se comprimen demasiado, el gas pasara a un estado líquido.
♦Al aumentar la temperatura, las partículas se mueven con más energía y chocan con más fuerza contra las paredes de su recipiente, lo que genera presión.
Ahora puedes preguntarte, en distintos lugares, ¿cuánto se desplazan los puntos de congelación, fusión y ebullicion?
Propiedades intensivas
Otro tipo de propiedades que caracterizan a la materia, son las llamadas particulares o intensivas; con ellas podemos diferenciar un material de otro. El valor de estas se mantiene constante aunque varíe la cantidad de materia que se esté midiendo: si calientas una taza de agua hervirá a la misma temperatura que si calientas dos litros.
Algunas propiedades intensivas son las densidad, la viscosidad, la temperatura de fusión, solubilidad y la temperatura de ebullición.
►Densidad
La densidad nos dice que tan ligera o pesada es la materia. Por ejemplo una bolita de algodón no pesa lo mismo que una de plastilina aunque ambas tengan el mismo volumen. Además la densidad nos permite saber si una sustancia flotará en el agua, ya que la densidad del agua es menor. Un pedazo de madera flota, pero si cambiamos el agua por gasolina, se hundiría ya que su densidad es mayor. La densidad se mide en kilogramos por metro cúbico (kg/m³)
►Viscosidad
Esta es una característica de los líquidos, ya que representa la tendencia de oposición de fluir de una sustancia. El hecho de fluir significa que cuando se es sometido a una fuerza, las moléculas son desplazadas por esta, dependiendo el tamaño de las moléculas, las más grandes se desplazarán más lento mientras que las más pequeñas más rápido. Los materiales que son viscosos, suelen ser pegajosos como la miel o los aceites, y al derramarse no se derraman fácilmente, si no que se quedan pegados. La sangre, es un poco más viscosa que el agua. La unidad de viscosidad es el Poise.
►Temperatura de fusión
Es la temperatura en la cual se produce el cambio de fase del estado sólido al líquido, o viceversa. Las temperaturas de inicio y final de este proceso se realizan al calentar una muestra de la sustancia a presión atmosférica. Si el líquido se sigue calentando sobre su punto de fusión, llegará a su punto de ebullición (que veremos un poquito más adelante) y a partir de esa temperatura se produce un nuevo cambio de estado de líquido a gaseoso. El agua, por ejemplo debajo de 0 grados se encuentra en estado sólido, ya que es su punto de congelación. De 0 a 99 permanece en estado líquido, porque rebasando los 0 grados se encuentra su temperatura de fusión, y encima de 100 pasa a estado gaseoso, al rebasar su punto de ebullición.
►Solubilidad
Es la capacidad que tiene una sustancia para disolverse en otra. La sustancia que se disuelve se conoce como soluto, y en su contraparte, la sustancia en la cuál se disuelve es el solvente. La concentración, representa la cantidad de soluto que hay en una disolución. Si hay mucho soluto, es una solución concentrada, y si hay poco es una solución diluida. La solubilidad depende también de la presión ambiental y la temperatura. Además de la presencia de otros solventes en la solución. Otros tipos de soluciones son la solución insaturada, que no tiene la máxima cantidad de soluto, pero mayor a la solución concentrada, la solución saturada, que tiene la máxima cantidad de soluto, y la solución sobresaturada, que tiene más soluto del que un solvente puede contener.
Algunas propiedades intensivas son las densidad, la viscosidad, la temperatura de fusión, solubilidad y la temperatura de ebullición.
►Densidad
La densidad nos dice que tan ligera o pesada es la materia. Por ejemplo una bolita de algodón no pesa lo mismo que una de plastilina aunque ambas tengan el mismo volumen. Además la densidad nos permite saber si una sustancia flotará en el agua, ya que la densidad del agua es menor. Un pedazo de madera flota, pero si cambiamos el agua por gasolina, se hundiría ya que su densidad es mayor. La densidad se mide en kilogramos por metro cúbico (kg/m³)
 |
| Un trozo de madera flotaría en el agua, un trozo de metal se hundiría. |
►Viscosidad
Esta es una característica de los líquidos, ya que representa la tendencia de oposición de fluir de una sustancia. El hecho de fluir significa que cuando se es sometido a una fuerza, las moléculas son desplazadas por esta, dependiendo el tamaño de las moléculas, las más grandes se desplazarán más lento mientras que las más pequeñas más rápido. Los materiales que son viscosos, suelen ser pegajosos como la miel o los aceites, y al derramarse no se derraman fácilmente, si no que se quedan pegados. La sangre, es un poco más viscosa que el agua. La unidad de viscosidad es el Poise.
 |
| ¿Recuerdan el frasco de mermelada que se rompió? |
►Temperatura de fusión
Es la temperatura en la cual se produce el cambio de fase del estado sólido al líquido, o viceversa. Las temperaturas de inicio y final de este proceso se realizan al calentar una muestra de la sustancia a presión atmosférica. Si el líquido se sigue calentando sobre su punto de fusión, llegará a su punto de ebullición (que veremos un poquito más adelante) y a partir de esa temperatura se produce un nuevo cambio de estado de líquido a gaseoso. El agua, por ejemplo debajo de 0 grados se encuentra en estado sólido, ya que es su punto de congelación. De 0 a 99 permanece en estado líquido, porque rebasando los 0 grados se encuentra su temperatura de fusión, y encima de 100 pasa a estado gaseoso, al rebasar su punto de ebullición.
►Solubilidad
Es la capacidad que tiene una sustancia para disolverse en otra. La sustancia que se disuelve se conoce como soluto, y en su contraparte, la sustancia en la cuál se disuelve es el solvente. La concentración, representa la cantidad de soluto que hay en una disolución. Si hay mucho soluto, es una solución concentrada, y si hay poco es una solución diluida. La solubilidad depende también de la presión ambiental y la temperatura. Además de la presencia de otros solventes en la solución. Otros tipos de soluciones son la solución insaturada, que no tiene la máxima cantidad de soluto, pero mayor a la solución concentrada, la solución saturada, que tiene la máxima cantidad de soluto, y la solución sobresaturada, que tiene más soluto del que un solvente puede contener.
 |
| Ahora el nombre del blog tiene un poquito de más sentido, ¿no? |
Suscribirse a:
Entradas (Atom)